Закон сохранения массы вещества является одним из основных законов химии. Он утверждает, что масса всех веществ, участвующих в химической реакции, не изменяется в ходе этой реакции. Это означает, что масса продуктов реакции равна сумме масс использованных веществ.
Для лучшего понимания принципа закона сохранения массы вещества, рассмотрим пример.
Представим, что у нас есть химическая реакция, в которой между веществами А и В происходит образование вещества С. Вещество А имеет массу mА, вещество В — массу mВ. По закону сохранения массы вещества, масса вещества С, образующегося в результате реакции, будет равна сумме масс веществ А и В: mС = mА + mВ.
Таким образом, закон сохранения массы вещества не только объясняет, почему масса продуктов реакции равна сумме масс использованных веществ, но и позволяет проводить расчеты и определение массы вещества, образующегося в результате реакции.
Что такое закон сохранения массы вещества?
Закон сохранения массы вещества базируется на предположении, что масса вещества не может быть создана или уничтожена во время химической реакции. Вместо этого, вещества переупорядочиваются и преобразуются в новые вещества, но общая масса остается неизменной.
Чтобы понять и применить закон сохранения массы вещества, можно использовать простой пример. Допустим, у нас есть реакция сгорания метана (CH4) в кислороде (O2), которая приводит к образованию углекислого газа (CO2) и воды (H2O).
| Реагенты | Продукты |
|---|---|
| Метан (CH4) | Углекислый газ (CO2) |
| Кислород (O2) | Вода (H2O) |
Согласно закону сохранения массы, общая масса метана и кислорода до реакции будет равна общей массе углекислого газа и воды после реакции. Например, если у нас есть 10 граммов метана и 20 граммов кислорода, то после реакции у нас будет 22 грамма углекислого газа и 8 граммов воды.
Таким образом, закон сохранения массы вещества играет важную роль в химических расчетах и позволяет предсказывать и описывать химические реакции с точки зрения массы вещества.
Определение и суть закона
Суть этого закона заключается в том, что масса вещества не создается и не исчезает во время химической реакции. Все реагенты и продукты реакции состоят из атомов, их масса сохраняется при превращении одних веществ в другие.
Этот закон является одним из фундаментальных принципов химии и имеет широкое применение в различных областях науки и промышленности. С его помощью можно определить массу получаемых веществ из заданных реагентов, проводить расчеты по количеству вещества и массе, а также проверять выполнение химических уравнений на соответствие закону сохранения массы.
Значение закона сохранения массы вещества
Закон сохранения массы вещества является фундаментальным и широко применяемым в химических расчетах и экспериментах. Он позволяет предсказывать изменения массы вещества, происходящие во время химической реакции, и обеспечивает основу для балансировки химических уравнений.
Этот закон также имеет важное значение в области природных наук и инженерии. Он помогает ученым и инженерам понять и описать физические и химические процессы, происходящие в природе или в технических системах.
Принцип сохранения массы применяется в различных областях, включая химическую синтез и анализ, фармацевтику, пищевую промышленность, экологию и другие сферы. Он обеспечивает надежную основу для проведения экспериментов, разработки новых материалов и технологий, а также для изучения и понимания природы и ее процессов.
Примеры применения закона сохранения массы
| Пример | Объяснение |
|---|---|
| Сжигание углеродных веществ | При сжигании углерода, например, в процессе горения угля или древесины, углерод соединяется с кислородом из воздуха, образуя углекислый газ. Масса углерода и кислорода в реагентах будет равна массе углекислого газа в продуктах реакции, согласно закону сохранения массы. |
| Реакции соляной кислоты с основаниями | При взаимодействии соляной кислоты с основаниями, такими как гидроксид натрия или гидроксид калия, образуется соль и вода. Общая масса реагентов будет равна общей массе продуктов реакции, согласно закону сохранения массы. |
| Электролиз | В процессе электролиза воды водгоникий газ и кислород образуются в равных количествах через разложение воды на составляющие элементы. Масса воды, которая разлагается на водород и кислород, будет равна общей массе продуктов реакции, согласно закону сохранения массы. |
Эти примеры демонстрируют, что масса веществ, участвующих в химических реакциях, остается постоянной и не создается и не уничтожается. Закон сохранения массы играет ключевую роль в определении количества вещества, участвующего в реакции, и позволяет химикам предсказать и анализировать результаты химических процессов.
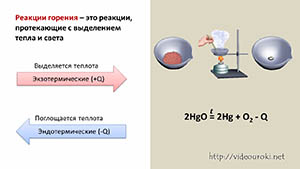
Пример 1: Реакция сжигания
Рассмотрим реакцию сжигания метана (CH4) в атмосфере:
CH4 + 2O2 → CO2 + 2H2O
Эта реакция является примером реакции окисления, где метан соединяется с кислородом и образует углекислый газ (CO2) и воду (H2O).
Закон сохранения массы вещества гласит, что в процессе химической реакции масса реагентов должна быть равна массе продуктов реакции. В данном случае, масса метана и кислорода в реагентах должна равняться массе углекислого газа и воды в продуктах реакции.
Таким образом, при сжигании 1 молекулы метана и 2 молекул кислорода образуется 1 молекула углекислого газа и 2 молекулы воды. Масса всех веществ остается неизменной.
Этот пример иллюстрирует основы закона сохранения массы в химии и его применение в реакциях сжигания и других химических процессах.
Пример 2: Растворение соли
Рассмотрим пример растворения соли в воде. Пусть у нас есть некоторое количество NaCl (хлорида натрия) в твердом состоянии. Когда мы добавляем этот твердый NaCl в воду, он начинает растворяться.
В химическом уравнении можно представить растворение NaCl следующим образом:
- NaCl (твердое состояние) → Na+ (растворенные ионы натрия) + Cl- (растворенные ионы хлорида)
Когда NaCl растворяется в воде, сохраняется количество атомов и ионов вещества. Поэтому масса раствора, полученного в результате растворения, остается равной сумме масс твердого NaCl и массы воды. Это явление объясняется законом сохранения массы вещества.
Например, если мы взвесим 10 г твердого NaCl и добавим его в 90 г воды, то после растворения масса раствора будет равна 10 г (масса твердого NaCl) + 90 г (масса воды) = 100 г.
Таким образом, пример растворения соли демонстрирует соблюдение закона сохранения массы вещества в химии.
Пример 3: Разложение воды на водород и кислород
При электролизе воды на катоде образуется молекулярный водород (H2), а на аноде — молекулярный кислород (O2). Реакция протекает следующим образом:
- На аноде: 2H2O -> O2 + 4H+ + 4е—
- На катоде: 4H2O + 4е— -> 2H2 + 4ОН—
Итак, электролиз воды позволяет получить водород и кислород в соотношении 2:1, то есть для каждых 2 молекул водорода образуется 1 молекула кислорода. При этом масса продуктов разложения воды (водорода и кислорода) будет равна массе вещества, которое подвергается электролизу.
Этот пример подтверждает закон сохранения массы вещества, согласно которому масса вещества, участвующего в реакции, остается неизменной.
Вопрос-ответ:
Что такое закон сохранения массы вещества?
Закон сохранения массы вещества утверждает, что во время химических реакций или превращений масса вещества сохраняется и остается неизменной.
Почему масса вещества сохраняется?
Масса вещества сохраняется, так как в химических реакциях не возникает и не исчезает никакая материя. Атомы просто переупорядочиваются и образуют новые вещества с той же суммарной массой, что и исходные вещества.
Может ли масса вещества измениться во время химической реакции?
Нет, масса вещества не изменяется при химической реакции. Например, если взять 10 граммов вещества и подвергнуть его химической реакции, то после реакции масса продуктов будет равна 10 граммам.
Как примерно объяснить закон сохранения массы вещества?
Можно представить шейкер с водой и льдом. В шейкере вода превращается в лед. В процессе превращения вода сжимается и объем шейкера уменьшается, однако масса вещества остается неизменной. Это объясняется тем, что при превращении воды в лед партикулы вещества все еще сохраняются и никакая масса не исчезает или не возникает.